-文献名-
Junko Watanabe, Mariko Watanabe, et al.
Effect of School-Based Home-Collaborative Lifestyle Education on Reducing Subjective Psychosomatic Symptoms in Adolescents: A Cluster Randomised Controlled Trial. PLOS ONE. October 25, 2016. DOI: 10.1371/journal.pone.0165285
-要約-
背景
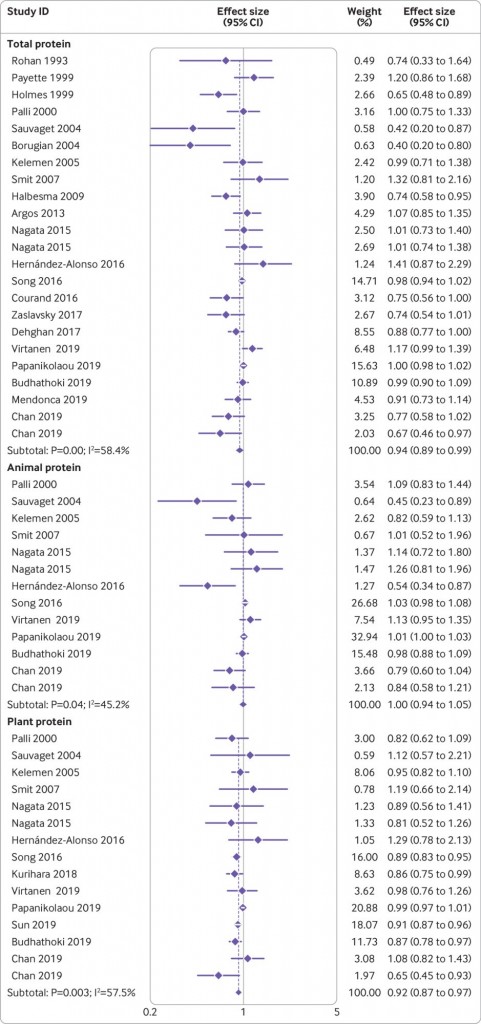
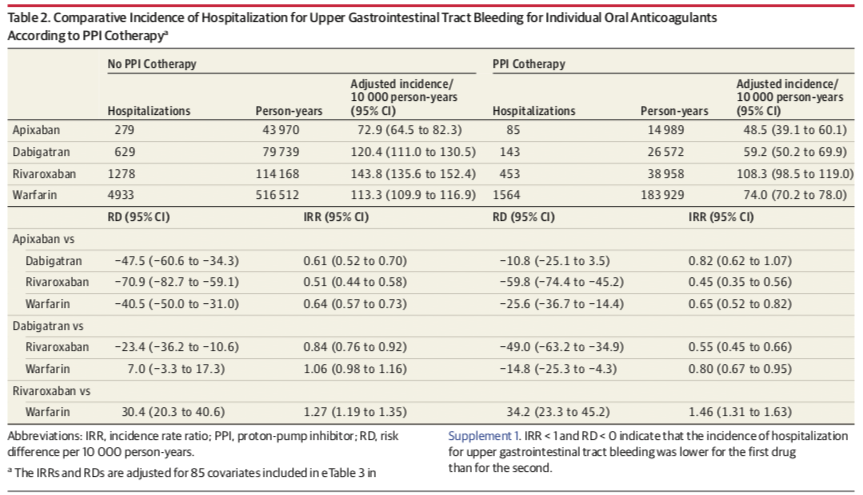
思春期は、思春期及それ以降の人生の、肥満[1-3]、メタボリックシンドローム[4]、および有害な心理学的(心身症または精神医学的)症状[5,6]などの潜在的な慢性的な健康問題を、改善または予防するためのいい機会であり、人生の重大なステージである[7]。肥満を予防するためのライフスタイルの改善方法に関する、学校ベースのクラスターランダム化比較試験が、西欧では数多く行われているが、アジアではほとんど行われていない。
また、肥満だけでなく、精神衛生上の問題も、世界中の子どもおよび青年の10~20%に見られると報告されている[15]。思春期のライフスタイルと主観的心身症状(SPS)スコアとの関連が報告されているが [16,17]、思春期のライフスタイルを変えるための介入がSPSスコアの改善に有効かどうかを検証した研究はほとんどない [18,19]。日本で、SPSスコアの悪い人が急速に増加していることを考慮すると[20]、日本の思春期の青少年に広く用いることのできる、効果的な生活習慣と行動の介入プログラムを開発することが重要である。
そこで我々は、思春期の青少年の不良なSPSスコアを改善するために、学校ベースで家庭とも協働した生活習慣教育プログラム(Program for ADOlescent of lifestyle education in Kumamoto, PADOK)を開発した。PADOKの設計は、先行研究[9, 21-25]で述べられた戦略に基づいており、各食事時の栄養摂取量を評価することで習慣的な食事摂取量を評価するために開発されたFFQW82食物頻度調査票を用いた評価によって、自発的に思春期の生活習慣を変え、食習慣についてのフィードバックを提供することを目的とした[22,23]。家庭での協力支援を加えることで、好ましい効果が得られる可能性がある。
方法
思春期の生徒を対象としたPADOKの主観的精神身体症状(SPS)の改善に対する有効性を検討した。
【研究デザイン】個々の中学校を配分単位とし、個々の参加者を分析単位とした2アーム型の学校ベースの2群並行クラスター比較対照試験。
【対象】熊本県の19の中学校から募集された、中学1〜2年生の生徒(12~14歳、n=1,565)を研究対象とした。体調不良などで登校していない生徒や、参加したくない生徒は除外した。
【ランダム化、盲検化など】
PADOKグループとコントロールグループには無作為化リストを用いてpermuted-block法で割り付けた。介入の特徴上、被験者への盲検化はできなかったが、評価者には盲検化していた。
【介入】介入は、2013年5月から2014年1月まで、保健の授業中に行われた。
<PADOKプログラム>:Figure 2参照。FFQW82を用いた食事摂取量の評価に基づき、思春期の生徒の不良なSPSを改善させる目的でPADOKプログラムが実施された。PADOKの介入は、6回の教室での授業、5回の生徒と保護者による対話型の宿題計画、授業と宿題のためのテイラーーメイドのテキストブック、そして6ヵ月に4回の学校通信で構成されていた。
<通常ケア>:通常の学校プログラム(対照群)の生徒は、通常のカリキュラムに従って学校が提供する健康教育セッションに参加した。セッションは、FFQW82を用いた食生活評価のために外部から招聘した講師によって提供された。通常のケアとは、参加している各学校で日常的に教えられている食事および/または運動に関する既存の健康カリキュラムであった。 Figure 1, 2
【栄養士・学習支援補助者の研修】
栄養士である試験指導者によって行われた。研修は終日(8~10時間)、試験管理センターで行われた。研修期間中、介入の根拠が説明され、各レッスンと宿題が対話的に議論された。
訓練を受けた4人のファシリテーターが、登録栄養士と一緒に各セッションを指導した。ファシリテーターは、少なくとも関連分野の大学の学部卒、適切な専門職歴、または思春期の子どもたちとの関わりの経験を有していた。すべてのセッションにおいて、介入はファシリテーターの観察下で行われた。
【アウトカム測定】
質問紙をベースライン時と介入6ヶ月後の時点で、学生に記入してもらった。
<プライマリアウトカム>SPSスコア。SPS質問紙は9つの症状(疲労感、頭痛、倦怠感、イライラ、集中力低下、意欲低下、朝の目覚めの悪さ、胃腸の不調、肩こり)から構成されている。各症状の経験の有無については、「0 = 一度もない」、「1 = まれに」、「2 = 時々」、「3=よくある」、「4=いつもある」 をリッカート尺度で測定し、9 項目のカテゴリ値の合計として SPS スコア(0-36 点)を算出した。SPS、SPS-Dともに、スコアが高いほど症状が悪い。
<セカンダリーアウトカム>学校生活の楽しみ、BMI、食事摂取量などの生活習慣因子をFFQW82で評価した(Table1参照)。FFQW82 は 82 種類の食品リストから構成されており、各食事(朝食、昼食、夕食)ごと、食品群ごとに、過去 1 ヶ月間の食生活を算出することができる。
【解析】
ベースラインでの試験群間のバランスを評価するために記述統計を用いた。クラスター無作為化が成功していることを確認するために、介入群と対照群の差の有意性をカイ二乗検定とt検定を用いて検討した。一次効果は、PADOK群と対照群のSPSスコアのベースラインから6ヵ月間の変化の差を計算することで評価した。一次分析は、intention to treat(ITT)で実施された。解析には最尤法を用いた線形ランダム効果混合モデルを用いた。連続変数の分析には、制限付き最尤法を用いた一般的な線形ランダム効果混合モデルを用いた。介入の効果を調べるために、アウトカム尺度を粗モデル(モデル1)、ベースライン値で調整したモデル(モデル2)、多変量データで調整したモデル(ベースライン、性、年齢、BMIで調整した)(モデル3)を用いた。
セカンダリーアウトカムについては ITT/LOCF 法を用いて二次解析を行った。感度解析は、ITT/LOCF の SPS-D スコアの解析を含む事前に決定された基準に従って、全データセットから特定されたプロトコルセット(PPS)を用いて、一次アウトカムと二次アウトカムの感度解析を行った。二次アウトカムについては、一般化線形ランダム効果混合モデル(ロジスティックモデル)を解析に使用し、関連性をオッズ比とその95%信頼区間(CI)で示した。
結果
【ベースライン】
Figure1参照。
参加19校はPADOK群(10校)と対照群(9校)に無作為に割り付けられた。登録された生徒数は1,509名であった。6ヵ月後、1,420人の参加者が身長、体重、SPS、生活習慣因子、食事摂取量(FFQW82)の最終評価を完了した。
Table1は、PADOK群と対照群に割り付けられた参加者のベースライン特性を示している。
SPSスコアのクロンバッハα係数は0.88であった。ベースライン時のSPSスコアはPADOK群23.2(3.9),対照群22.8(6.6)であった。ベースライン時の各測定された生活習慣因子とエネルギー摂取量(kJ)を持つ参加者の割合は、両群間で大きな差はなかった。ベースライン時の「1回の断食あたりに消費された野菜」については、介入群と対照群の間に統計的に有意な差(P = 0.012)があった。対照群では、介入群よりも高い頻度で習慣化していた。
【プライマリアウトカム】
ITT/LOCF解析で評価した6ヵ月後のSPSスコアのベースラインからの平均変化量は、粗平均差ではPADOK群が対照群に比べて有意に減少した(-0.95、95%CI-1.70~-0.20、P = 0.016)。SPSスコアの減少(すなわち、負の変化)は、対照群と比較して介入群のSPSの改善を示している。ベースライン調整値(-0.72、95%CI -1.48~0.04、P = 0.063)およびマルチバリアート調整値(-0.68、95%CI -1.58~0.22、P = 0.130)のベースラインからの平均変化は、同様の方向性を示したが、有意ではなかった(表2)。ITT/MI法で得られた結果もこれらと同様であった。SPS-Dスコアについては、粗値、ベースライン調整値、マルチバリアート調整値でベースラインからの平均変化が有意であった。また、感度分析では、各分析とも同様の結果が得られた。
【セカンダリーアウトカム】
PADOK群では、ITT/LOCF分析の結果に応じて、測定された生活習慣のいくつかが改善された。これらの改善(モデル2およびモデル3ではオッズ比[OR]<1)が会ったのは、「学校生活を楽しむ」(OR [95%CI]:0.55 [0.33~0.92]、P=0.022、0.52[0.33~0.84]、P=0.008)、「朝食1回あたりの主食消費量」(0.69[0.50~0.96]、P=0.028、0.68[0.48~0. 65])、「朝食あたりの主食消費量」(0.69[0.50~0.96]、P=0.025)、「朝食あたりの野菜消費量」(0.65[0.45~0.93]、P=0.018)であった。モデル3のものは、これと同様であった(表3)。
感度分析(PPS分析)で得られた結果は、上記とほぼ同様の結果が得られた(表3、表4参照)。また、FFWQ82で評価した食事摂取量については、PADOK群と対照群との間に有意な差は認められなかった。
ディスカッション
PADOKの介入プログラムは思春期のSPSスコアの改善に有効であることが示唆された。また、学校生活の主観的な楽しみ、主食、主菜、主菜、朝食時に消費される野菜の1日の摂取量の増加など、いくつかの生活習慣の改善も観察された。
私たちの調査結果は、定期的に朝食を食べた学生は、学校でより良い行動を取り、そうでない人よりも仲間とうまくやっていく可能性が高いことを報告した先行研究のものと一致していた [33]。瞑想、リラクゼーション、レクリエーション、自然の中での時間など、治療的なライフスタイルの変化の多くは楽しいものであり、それゆえに自立した健康的な習慣になる可能性がある [34]。
PADOK群の生徒の先生方が生活習慣教育の重要性についての考え方を変え、一般授業での改善を目指していた可能性は否定できない。そうであれば、それはPADOK介入の副次的効果と考えることができる。PADOKがSPSの低減と健康促進のための生活習慣行動の促進にどのような効果があるのか、その詳細なメカニズムを明らかにするためには、さらなる研究が必要である。
強みと限界
我々は、介入に生徒の保護者を参加させることが重要であると考えた [38]。これを達成するために、生徒はPADOKプログラムから得た知識を保護者と話し合うように求められた。家庭での協力的な支援を含めることは、好ましい効果を得るのに役立つかもしれない。思春期の生徒の身体活動介入に関する以前のクラスター化RCTでは、親の支援を含む介入により、学校関連の身体活動の自己報告が増加した [12, 39]。我々の研究では、生徒、その保護者、登録栄養士の間の情報交換に教科書を使用した。教科書のノートを利用することで、3 者間での自由な情報交換が可能であった。このように、3者間での共通理解が生まれることが期待された。
本研究にはいくつかの限界があった。第一に、PADOKプログラムの成功は管理栄養士のスキルにある程度依存していることである。この問題に対処するために、我々は登録管理栄養士が無作為化試験開始前に行うトレーニングプロセスを開発した。また、SPSの自己申告による評価に依存し、診断的な相互評価は行っていない。したがって、SPSの状態に重要な変化があった可能性がある。
第三に、結果の一般化可能性については、熊本県の日本人中学生に限定した。また、当初 178 校に参加を依頼したところ、19 校が参加に同意し、残りの 159 校は参加を辞退した。その理由として最も多かったのは、「カリキュラムが既に決まっていて変更できない」というものであった。そのため、本試験に含まれるサンプルセットは、平均よりも革新的な学校を過剰に代表している可能性があり、バイアスのリスクがあると考えられる。しかし、無作為化を実施したので、リスクが存在することは否定できないが、バイアスのリスクは小さい。利用可能なデータ[20]によれば、熊本の生徒の健康状態や活動状況は日本の平均的な青年期と大差がなかったことを考えると、この結果は日本の他県の一般的な青年期にも当てはまる可能性がある。第四に、介入期間は6ヶ月であったが、より長期の介入は児童生徒の精神衛生を改善することが明らかにされている[40]。さらに、健康行動介入がメンタルヘルスのアウトカムに「波及効果」を持つ可能性があるという証拠も出てきており[41, 42]、これも考慮すべきである。PADOKプログラムの長期的な効果と費用対効果を評価するためにはさらなる研究が必要である。第5に、クラスタランダム化が成功したことを確認するために、介入群と対照群の間のベースライン値の差を調査した。いくつかの変数が有意な差を示したが、ランダム化の性質上、これらの差は偶然に生じたものである可能性があると考えられる。最後に、LOCF法を用いて欠落アウトカムを推定した。介入群と対照群のフォローアップまでの喪失率は同程度であった(それぞれ40[5.0%]、49[4.9%])。
結論
これまでのところ、日本の青年期に生活習慣の介入を行うことが不良なSPSスコアの改善に及ぼす効果については、クラスターRCTからのエビデンスが不足していた。我々の試験は、この文献のギャップを埋めるものである。その結果、熊本の中学校で実施された生活習慣介入プログラムは、青年のSPSスコアを改善し、朝食時に主食、主菜、野菜を毎日定期的に摂取し、学校生活の楽しみが増えたと報告する参加者の割合を増加させたことが示された。この試験集団はPADOKプログラムのアドヒアランス率が中程度に高いことを示しており、これは、より広範な学校ベースの家庭での共同実践においてPADOKプログラムが実現可能であることを示す重要な指標である。本研究は、熊本地域の児童生徒のみならず、日本の青少年全般を対象とした生活習慣教育介入を設計する上で有用な情報を提供するものである。





【開催日】2020年10月7日(水)